No. SK: HK.02.02.33.332.03.23.19
- Surat persetujuan penggunaan fasilitas bersama yang telah dimiliki (jika ada);
- Data kapasitas terpasang, kapasitas terpakai dan kapasitas belum terpakai (idle) untuk tiap peralatan produksi yang digunakan bersama
- Data kapasitas laboratorium, kapasitas terpakai dan kapasitas belum terpakai (idle) untuk tiap peralatan uji yang digunakan bersama
- Surat Pernyataan dari Quality Assurance Manager atau personil yang diberi wewenang di atas kertas bermaterai yang menyatakan bahwa: i. Kapasitas produksi yang belum terpakai mencukupi untuk memproduksi produk nonterapetik; ii. Pengujian produk nonterapetik tidak memengaruhi pengujian produk terapetik;
- Menjamin layout gudang dengan lokasi penyimpanan bahan baku, bahan kemas dan produk jadi produk terapetik dan nonterapetik secara terpisah
- Matriks data produk nonobat: i. yang telah diproduksi sesuai dengan surat persetujuan yang dimiliki pada fasilitas obat sesuai bentuk sediaan; ii. dan/atau yang akan diproduksi sesuai dengan permohonan pada fasilitas obat sesuai bentuk sediaan.
- Matriks data peralatan produksi yang digunakan bersama
- Dokumen terkait Pemenuhan Standar CPOB: i. Rencana Induk Validasi yang mencakup kebijakan validasi pembersihan; ii. Protap pembersihan peralatan yang digunakan bersama; iii. Protap pembersihan ruangan yang digunakan bersama; iv. Protokol validasi pembersihan peralatan yang digunakan bersama; v. Risk assessment/kajian penetapan marker yang mencakup faktor risiko dari produk nonobat yang akan diproduksi di fasilitas bersama, tidak terbatas pada dosis terapetik terkecil, toksisitas, dan kelarutan; dan vi. Protokol dan laporan validasi metode analisa produk marker yang mencakup recovery swab dan/atau rinse test.
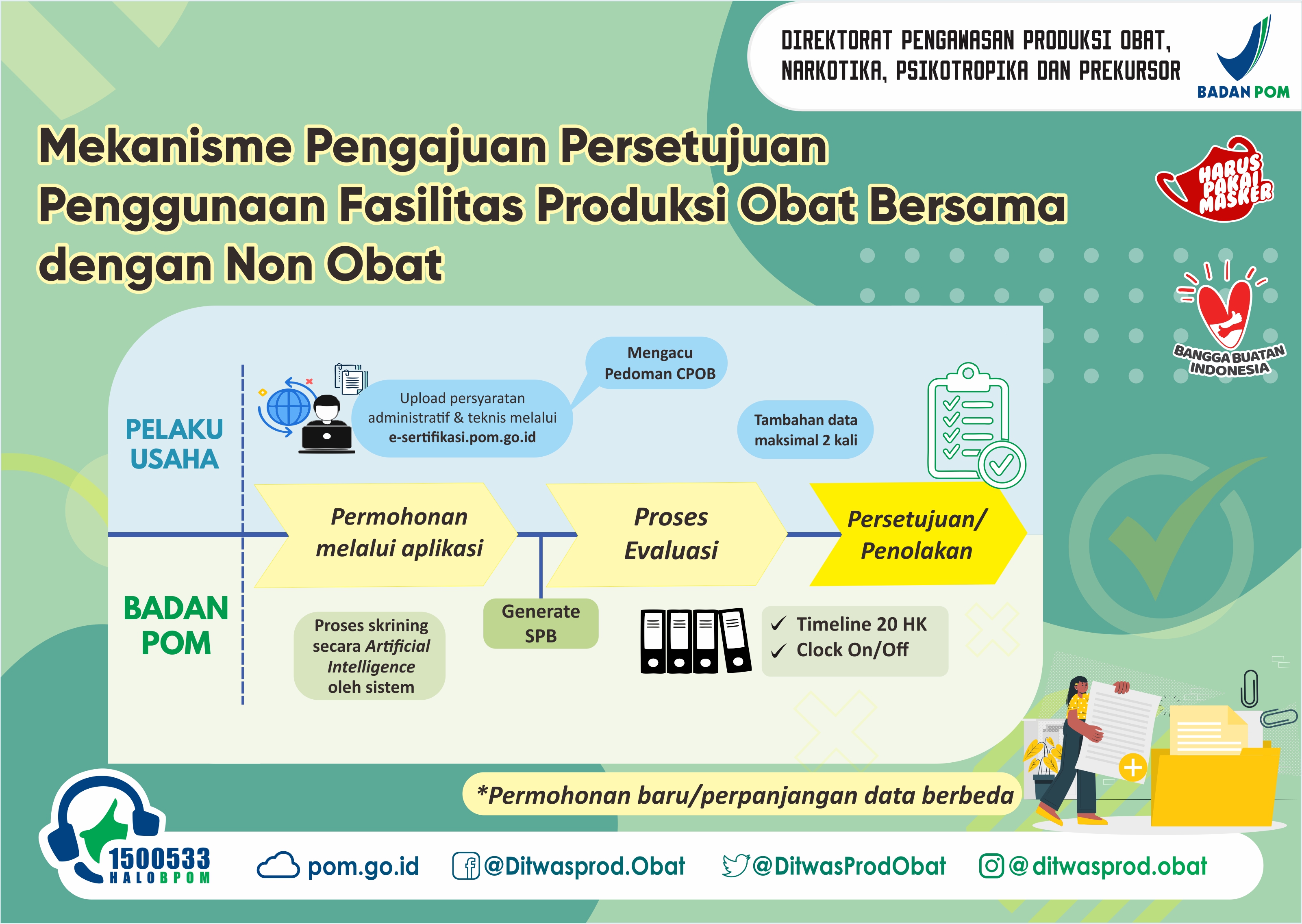
- Pendaftar mengajukan permohonan melalui laman pelayanan OSS – RBA yang terintegrasi dengan e-sertifikasi.pom.go.id dengan melakukan input data dan mengunggah dokumen pendukung
- Permohonan yang telah lengkap dan dapat diterima sistem akan dilanjutkan dengan proses penerbitan kode billing
- Setelah pembayaran PNBP dilakukan maka pengajuan akan terkirim ke Badan POM untuk selanjutnya dapat diproses
- Dilakukan evaluasi terhadap isian data pada aplikasi dan dokumen pendukung yang di unggah
- Hasil evaluasi dapat berupa perbaikan atau penerbitan surat persetujuan penggunaan bersama fasiltas obat dan nonobat
- Hasil evaluasi berupa perbaikan disampaikan ke pemohon melalui sistem e-sertifikasi
- Proses penyerahan perbaikan oleh pemohon data diproses sesuai tahapan nomor 1 – 5
- Apabila CAPA belum sesuai setelah 2 (dua) kali perbaikan, Badan POM menyampaikan surat penolakan permohonan penggunaan bersama fasilitas obat dan nonobat
- Hasil evaluasi berupa Penerbitan Persetujuan atau Penolakan akan diproses pada sistem e-sertifikasi dan disampaikan ke pemohon melalui sistem e-sertifikasi
Biaya Evaluasi dan Penerbitan Sertifikasi CPPOB berdasarkan Peraturan Pemerintah Nomor 32 Tahun 2017 tentang Jenis dan Tarif atas Jenis Penerimaan Negara Bukan Pajak (PNBP) yang berlaku pada BPOM sebesar Rp 5.000.000per komoditi per bentuk sediaan
Persetujuan Penggunaan Fasilitas Produksi Obat bersama Nonobat
a. Pengaduan, saran, dan masukan disampaikan secara langsung kepada Badan POM melalui Unit Layanan Pengaduan Konsumen atau melalui media, meliputi:
1) kanal pengaduan SP4N-LAPOR!:
a) website : lapor.go.id;
b) sms : 1708; dan
c) aplikasi android/iOS: SP4N LAPOR!
2) Telepon :1500-533
3) SMS : 081.21.9999.533
4) Whatsapp : 081.191.81.533
5) Subweb : www.ulpk.pom.go.id
6) media sosial:
a) instagram : @bpom_ri
b) twitter : @BPOM_RI; dan
c) facebook : @bpom.official
7) surat elektronik/email: halobpom@pom.go.id
8) Aplikasi BPOM Mobile.
b. Pengaduan, saran, dan masukan dapat disampaikan langsung kepada unit penyelenggaraan pelayanan publik, melalui:
1) Surat yang ditujukan kepada: Direktur Pengawasan Produksi Obat, Narkotika, Psikotropika dan Prekursor, Gedung Merah Putih Lantai 5 - Jl Percetakan Negara No 23 Jakarta Pusat;
2) Telepon: 021-4245459 (Ext. 3598)
3) Email: ditwasprod@pom.go.id;
4) Web: klikcpob.pom.go.id;
5) Media sosial:
a) Instagram: @wasprodobat.bpom;
b) Facebook: Direktorat Pengawasan Produksi Obat NPP BPOM; dan
c) Twitter: @wasprodobatbpom
Unit penyelenggaraan pelayanan publik yang menerima pengaduan, saran, dan masukan menyampaikan laporan kepada Unit Layanan Pengaduan Konsumen Pusat.
Anda juga dapat menyampaikan pengaduan, aspirasi, maupun permintaan informasi melalui aplikasi LAPOR!
Melalui LAPOR!, Anda dapat menyampaikan permasalahan pelayanan publik yang Anda temui dalam satu kanal sehingga laporanmu dapat kami sampaikan ke instansi terkait.
Website LAPOR! Unduh di Play Store Unduh di App Store











