No. SK: HK.02.02.33.332.03.23.19
- Pengkajian Mutu Produk yang didaftarkan 2 tahun terakhir
- Rencana Induk Validasi dan realiasi RIV tahun terakhir
- 3) Protokol dan Summary Report Validasi Pengisian Media 1 tahun terakhir (jika produk yang didaftarkan diproduksi secara aseptis)
- Analisis Tren Pemantauan Lingkungan dan Hasil Pengujian Air 1 tahun terakhir
- Protap Pelulusan Produk Akhir
- Protap Pelulusan Produk Akhir
- Tambahan dokumen lain yang diminta sesuai hasil evaluasi desktop inspection sebelumnya (jika ada)
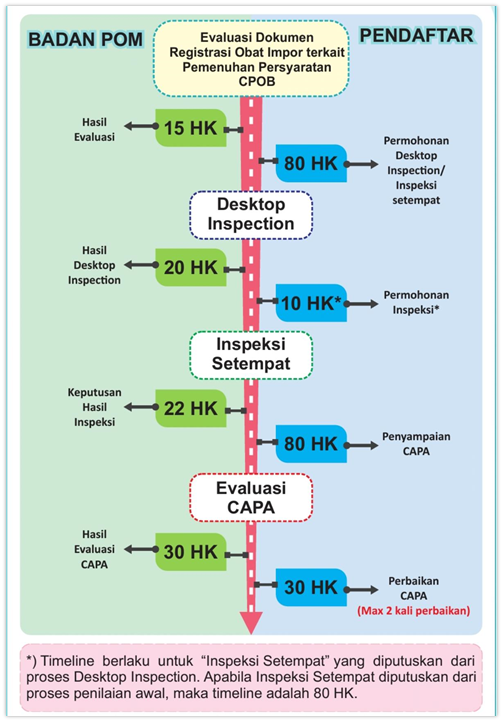
- Inspeksi Setempat Fasilitas Pembuatan Obat Impor merupakan Tahapan Proses Penilaian Pemenuhan Persyaratan CPOB Fasilitas Pembuatan Obat Impor. Setelah mendapatkan keputusan Inspeksi Setempat, Pendaftar melakukan pengajuan melalui aplikasi e-sertifikasi.pom.go.id.
- Jika keputusan Inspeksi setempat berdasarkan hasil penilaian dokumen registrasi obat impor terkait pemenuhan persyaratan CPOB, maka dilakukan Screening awal Dokumen Pra inspeksi (sesuai yang tercantum pada persyaratan) terlebih dahulu. Jika dokumen yang disampaikan belum lengkap, dokumen akan dikembalikan kepada Pendaftar
- Jika keputusan Inspeksi Setempat berdasarkan hasil Desktop Inspeksi, maka tidak perlu mengajukan Dokumen Pra Inspeksi kembali.
- Setelah dinyatakan lengkap dan dilakukan pembayaran PNBP oleh Pendaftar, dilakukan koordinasi lebih lanjut terkait penentuan jadwal Inspeksi
- Setelah dilakukan inspeksi, diterbitkan Laporan Inspeksi dan Surat Tindak Lanjut melalui aplikasi -sertifikasi.pom.go.id
Setelah Pelaksanaan Inspeksi Setempat
Audit sarana produksi obat impor (per fasilitas) Rp 50.000.000
Biaya tersebut tidak termasuk biaya transportasi dan akomodasi pelaksanaan inspeksi dan pembiayaan ini wajib dilaporkan kepada Badan POM
Hasil Penilaian Pemenuhan Persyaratan CPOB Fasilitas Pembuatan Obat Impor
a. Pengaduan, saran, dan masukan dapat disampaikan secara langsung kepada Badan POM melalui Unit Layanan Pengaduan Konsumen atau melalui media, meliputi:
1) Kanal pengaduan SP4N-LAPOR!:
a) Website: lapor.go.id;
b) SMS: 1708; dan
c) Aplikasi android/iOS: SP4N LAPOR!
2) Telepon:1500-533
3) SMS: 081.21.9999.533
4) Whatsapp: 081.191.81.533
5) Subweb: www.ulpk.pom.go.id
6) Media sosial:
a) Instagram: @bpom_ri
b) Twitter: @BPOM_RI; dan
c) Facebook: @bpom.official
7) Surat elektronik/email: halobpom@pom.go.id
8) Aplikasi BPOM Mobile.
b. Pengaduan, saran, dan masukan dapat disampaikan kepada unit penyelenggaraan pelayanan publik, melalui:
1) Surat yang ditujukan kepada: Direktur Pengawasan Produksi Obat, Narkotika, Psikotropika dan Prekursor, Gedung Merah Putih Lantai 5 - Jl Percetakan Negara No 23 Jakarta Pusat;
2) Telepon: 021-4245459 (Ext. 3598)
3) Email: ditwasprod@pom.go.id;
4) Web: klikcpob.pom.go.id;
5) Media sosial:
a) Instagram: @wasprodobat.bpom;
b) Facebook: Direktorat Pengawasan Produksi Obat NPP BPOM; dan
c) Twitter: @wasprodobatbpom
c. Unit penyelenggaraan pelayanan publik yang menerima pengaduan, saran, dan masukan menyampaikan laporan kepada Unit Layanan Pengaduan Konsumen Pusat.
Anda juga dapat menyampaikan pengaduan, aspirasi, maupun permintaan informasi melalui aplikasi LAPOR!
Melalui LAPOR!, Anda dapat menyampaikan permasalahan pelayanan publik yang Anda temui dalam satu kanal sehingga laporanmu dapat kami sampaikan ke instansi terkait.
Website LAPOR! Unduh di Play Store Unduh di App Store











