No. SK: HK.02.02.33.332.03.23.19
- Bukti Pengajuan Proses Registrasi Obat Impor
- Surat Pernyataan Kelengkapan dan Kebenaran Dokumen dari Pendaftar
- Izin industri farmasi dari otoritas negara setempat atau izin operasional lain apabila fasilitas pembuatan bukan merupakan industri farmasi
- Sertifikat CPOB yang masih berlaku atau dokumen lain yang setara yang dikeluarkan oleh otoritas pengawas Obat setempat dan/atau otoritas pengawas Obat negara lain
- Laporan hasil Inspeksi terakhir dan perubahan terkait fasilitas produksi produk yang didaftarkan dalam waktu paling lama 2 (dua) tahun yang dikeluarkan oleh otoritas pengawas Obat setempat dan/atau otoritas pengawas Obat negara lain
- Status CAPA terakhir jika pada laporan inspeksi terdapat minimal temuan Mayor
- SMF/DIIF terkini sesuai dengan Pedoman Penyiapan Dokumen Induk Industri Farmasi (DIIF) Edisi Tahun 2011 atau Quality Agremeent atau dokumen lain yang setara, apabila fasilitas pembuatan bukan merupakan industri farmasi
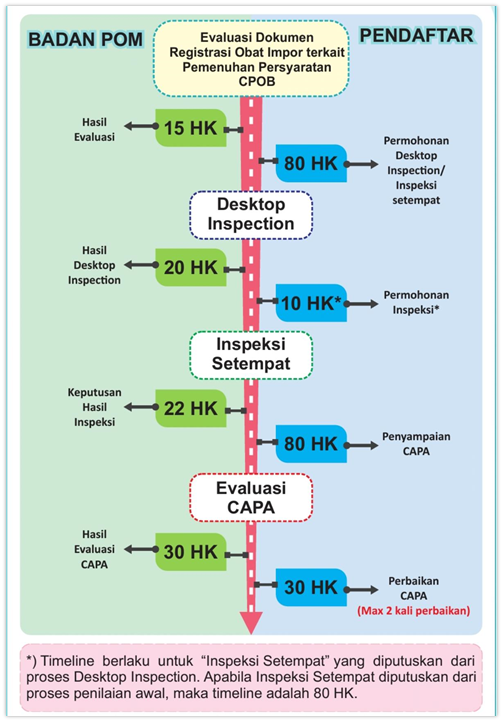
- Pendaftar mengajukan permohonan penilaian pemenuhan persyaratan CPOB fasilitas pembuatan obat impor melalui Online Single Submission – Risk Based Approach (OSS–RBA) dan terintegrasi dengan e-sertifikasi.pom.go.id disertai dengan dokumen persyaratan. Sebelumnya pendaftar memastikan akun yang dimiliki telah aktif untuk jenis layanan "OBAT IMPOR"
- Permohonan diterima oleh BPOM, untuk dilakukan seleksi awal kelengkapan persyaratan;
- Jika berdasarkan seleksi awal dokumen dinyatakan tidak lengkap, dokumen dikembalikan kepada pendaftar untuk dilengkapi;
- Setelah dinyatakan lengkap, dilakukan evaluasi terhadap dokumen yang disampaikan;
- Hasil penilaian dapat berupa Fasilitas memenuhi syarat, Diperlukan Desktop Inspection, Diperlukan Inspeksi Setempat, atau Fasilitas tidak memenuhi syarat.
Setelah berkas dinyatakan lengkap
Tidak dipungut biaya
Hasil Penilaian Pemenuhan Persyaratan CPOB Fasilitas Pembuatan Obat Impor
a. Pengaduan, saran, dan masukan dapat disampaikan secara langsung kepada Badan POM melalui Unit Layanan Pengaduan Konsumen atau melalui media, meliputi:
1) Kanal pengaduan SP4N-LAPOR!:
a) Website: lapor.go.id;
b) SMS: 1708; dan
c) Aplikasi android/iOS: SP4N LAPOR!
2) Telepon:1500-533
3) SMS: 081.21.9999.533
4) Whatsapp: 081.191.81.533
5) Subweb: www.ulpk.pom.go.id
6) Media sosial:
a) Instagram: @bpom_ri
b) Twitter: @BPOM_RI; dan
c) Facebook: @bpom.official
7) Surat elektronik/email: halobpom@pom.go.id
8) Aplikasi BPOM Mobile.
b. Pengaduan, saran, dan masukan dapat disampaikan kepada unit penyelenggaraan pelayanan publik, melalui:
1) Surat yang ditujukan kepada: Direktur Pengawasan Produksi Obat, Narkotika, Psikotropika dan Prekursor, Gedung Merah Putih Lantai 5 - Jl Percetakan Negara No 23 Jakarta Pusat;
2) Telepon: 021-4245459 (Ext. 3598)
3) Email: ditwasprod@pom.go.id;
4) Web: klikcpob.pom.go.id;
5) Media sosial:
a) Instagram: @wasprodobat.bpom;
b) Facebook: Direktorat Pengawasan Produksi Obat NPP BPOM; dan
c) Twitter: @wasprodobatbpom
c. Unit penyelenggaraan pelayanan publik yang menerima pengaduan, saran, dan masukan menyampaikan laporan kepada Unit Layanan Pengaduan Konsumen Pusat.
Anda juga dapat menyampaikan pengaduan, aspirasi, maupun permintaan informasi melalui aplikasi LAPOR!
Melalui LAPOR!, Anda dapat menyampaikan permasalahan pelayanan publik yang Anda temui dalam satu kanal sehingga laporanmu dapat kami sampaikan ke instansi terkait.
Website LAPOR! Unduh di Play Store Unduh di App Store











